
科研团队合影

鲁伯埙教授和学生

丁澦副教授和学生

费义艳副研究员和学生
亨廷顿病(或称亨廷顿舞蹈症)位列四大神经退行性疾病之一,临床表现为不自主的舞蹈样动作、认知障碍、精神异常等症状。由于引起该病的变异亨廷顿蛋白(mHTT)生化活性未知,无法靶向,传统依靠阻断剂以阻断致病蛋白活性的方法并不适用。
近日,复旦大学生命科学学院鲁伯埙与丁澦课题组和复旦大学信息科学与工程学院光科学与工程系费义艳课题组等多学科团队通力合作,开创性地提出基于自噬小体绑定化合物(ATTEC)的药物研发原创概念,并巧妙地通过基于化合物芯片和前沿光学方法的筛选,发现了特异性降低亨廷顿病致病蛋白的小分子化合物,有望为亨廷顿病的临床治疗带来新曙光。
北京时间10月31日凌晨,相关研究成果《HTT-LC3连接化合物对变异HTT蛋白的等位基因选择性降低》(“Allele-selective Lowering of Mutant HTT Protein by HTT-LC3 Linker Compounds”)以长文(Article)形式发表于《自然》(Nature)主刊。鲁伯埙、费义艳和丁澦为该论文通讯作者,复旦大学博士生李朝阳、王岑、王紫英和朱成钢为第一作者。该研究工作受到了国家自然科学基金委以及国家科技部等多个项目的资助。
开辟新思路:“小分子胶水”助力细胞自噬“吞没”致病蛋白
既然运用阻断剂阻断或抑制致病蛋白的传统道路行不通,团队另辟蹊径,着眼于驾驭细胞自噬这一细胞内蛋白降解途径以有效降低变异亨廷顿蛋白水平。在自噬过程中,关键蛋白LC3被脂化后聚合扩增,形成膜结构,并将蛋白、脂类、细胞器等降解目标包裹于其中,形成完整的自噬小体(autophagosome),与溶酶体融合后,其中包裹的物质得以降解。
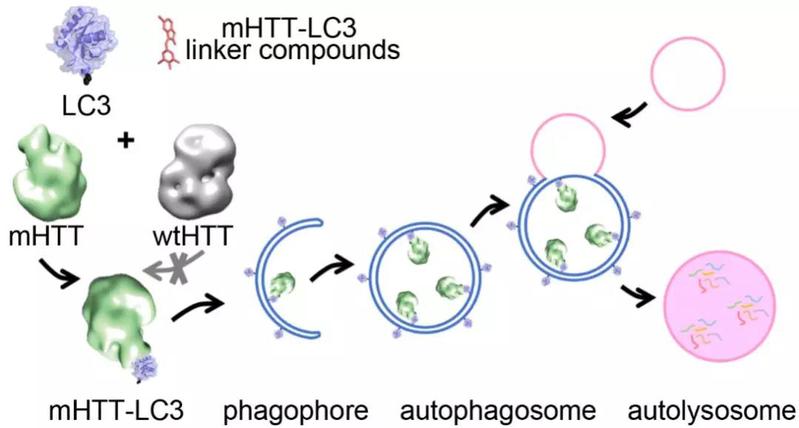
以致病蛋白mHTT为例,该细胞自噬过程简单示意图
然而,自噬的降解功能强大,若自噬功能整体增强而缺乏特异性,会降解所有包裹进自噬小体的蛋白,这样一来,承担着神经保护功能的正常野生型亨廷顿蛋白以及其它发挥重要功能的蛋白也易被“误吞”。伤敌一千,却自损八百,并非理想之策。
如何在排除野生型亨廷顿蛋白的情况下,特异性地绑定致病蛋白进入自噬小体?团队设想发明一种小分子绑定化合物ATTEC (Autophagosome Tethering Compounds),或称之为“小分子胶水”,能够直瞄靶心,牢牢地将LC3及致病蛋白(或其他致病物质)黏在一起,进而将致病蛋白包裹进入自噬小体进行降解。同时,“小分子胶水”并不黏附野生型亨廷顿蛋白,使其得以安然无恙。经过筛选、纯化及系列细胞实验后,团队共获四个符合要求的理想化合物。

发光的小分子胶水连接了致病蛋白mHTT(蓝色)和自噬小体蛋白(紫色),将其带入自噬小体进一步降解
至此,研究所得分子已具备满足理想条件的理论可行性,而是否可适用于动物细胞和人体细胞,通过给药达到预期功效,则需进一步研究验证。
团队发现,这四个化合物在小鼠神经元、亨廷顿病病人细胞以及亨廷顿病果蝇模型中,均可显著降低变异亨廷顿蛋白水平,而对野生型亨廷顿蛋白水平几乎没有影响,且起效浓度在纳摩尔级别(10 nM)。更令团队感到惊喜的是,“这四种化合物中有至少两种,可以跨过血脑屏障,并通过低剂量腹腔给药直接降低亨廷顿病小鼠的大脑皮层及纹状体的变异亨廷顿蛋白水平,而不影响脑组织中的野生型亨廷顿蛋白水平,也改善了疾病相关的表型,为亨廷顿病口服或注射药物的研发提供了切入点。”鲁伯埙介绍道。
学科新交叉:小分子芯片和光学检测技术实现高通量筛选
事实上,此类“小分子胶水”并不好找。若逐一对数千种化合物进行细胞分析检验,以从中甄别出符合理想性状的几种目标分子,无疑如大海捞针,这也一度成为团队研究道路上的一大障碍。
而信息科学与工程学院光科学与工程系费义艳课题组的加盟则为“小分子胶水”的发现带来了新的可能。该课题组发展了基于小分子芯片(Small Molecule Microarray, SMM)和免标记斜入射光反射差(Oblique-Incidence Reflectivity Difference, OI-RD)技术的新型高通量药物筛选平台,能够快速、灵敏、无标记地从成千上万种小分子化合物中找到与靶标蛋白结合的小分子。
课题组将近四千种小分子化合物点样于芯片上,当靶标蛋白流过时,若它能够与固定在芯片上的特定小分子结合,则该位置的分子层厚度增加,这一微小变化即可被光学方法(斜入射光反射差技术)灵敏检测。采用这种新型的药物筛选方法,课题组共找到两种小分子,它们既能够与LC3蛋白结合,也能够与变异亨廷顿蛋白结合,但不与野生型亨廷顿蛋白结合。通过对具有类似结构的小分子化合物的检测,共获得四种可绑定LC3与变异亨廷顿蛋白的“小分子胶水”。
应用新前景:自噬小体绑定化合物打造药物研发新概念
团队决定打破砂锅问到底,进一步探究这些小分子化合物能够区分变异亨廷顿蛋白与野生型亨廷顿蛋白的内在机制。变异亨廷顿蛋白和正常蛋白结构基本无异,唯一的差别就在于变异蛋白含有过长的谷氨酰胺重复(polyQ)。而这些化合物之所以能够“明辨忠奸”,正是因为其可选择性地结合变异亨廷顿蛋白所特有的过长polyQ区域,根据这一特性对两者予以区分。
依据这一特性,团队意识到这些小分子化合物的用武之地也许远不止亨廷顿病这一种疾病。目前已知有九种polyQ疾病,都是由特定的含有过长polyQ的突变蛋白所导致。脊髓小脑性共济失调III型疾病就是一例,它是中国人群中发病率最高的polyQ疾病,临床表现为运动的协调障碍、无法维持躯体姿势和平衡等,可伴有突眼、腱反射亢进、面肌颤搐、肌痉挛等症状。团队利用复旦大学附属华山医院教授王坚课题组孙一忞医生提供的共济失调III型病人细胞进行了检测,发现这些化合物均可以有效降低引起该病的变异蛋白(polyQ长度为74)水平,而不影响其野生型蛋白水平(polyQ长度为27)。
“这些化合物不仅可能对亨廷顿病的治疗有效,也可能运用于其它polyQ疾病;自噬小体绑定化合物(ATTEC)这一药物研发新概念,也有望应用于其它无法靶向的致病蛋白,甚至非蛋白的致病物质。”谈及成果未来应用前景,鲁伯埙充满期待。
神经退行性疾病领域著名科学家Huda Zoghbi(美国科学院院士、科学突破奖(breakthrough prizes)获得者)为该研究撰写了专文评论,发表于Nature,正面评价推荐了此项研究。




